こんにちは⭐ ミドリケムです。
本日はリチウムイオン電池について解説していこうかと思います。
リチウムイオン電池、皆さん一度は耳にしたことはありますよね?小さくて軽いにも関わらず、パワーがありノートパソコンやスマートフォン、さらにはドローンにも使用されている二次電池(充電可能な電池)です。
これを開発した吉野彰さん(旭化成株式会社)、ジョン・グッドイナフさん、さらにはスタンリー・ウィッティンガムさんは2019年にノーベル化学賞を受賞しました。リチウムイオン電池のおかげでわれわれは電子機器を長時間使用できるわけですね。
やはりノーベル化学賞を受賞しただけあって、開発はそう簡単ではなく茨の道でした。順を追って解説していきます。
リチウム電池とは?
まずは「リチウム電池」からです。今回のブログで解説するのは「リチウムイオン電池」ですが、初めは名称にイオンがありませんでした。
皆さんリチウムLiは覚えていますか? イオン化傾向が最も高くすぐに酸化される元素です。反応式ではLi→Li++e–です。言い換えると、とてつもなくパワーを持っています。それだけではありません。リチウムLiは原子番号3番、つまり金属の中で最も軽い金属なのです。
つまりリチウムLiは大きなパワーを持ち、しかも軽量化も可能です。これはもうパソコンやスマートフォンの電池にもってこいですね♪
リチウム電池の放電は以下の図の通りです。ちなみに、リチウムは水と過激に反応するため、溶媒は基本的に有機溶媒が使用されます。
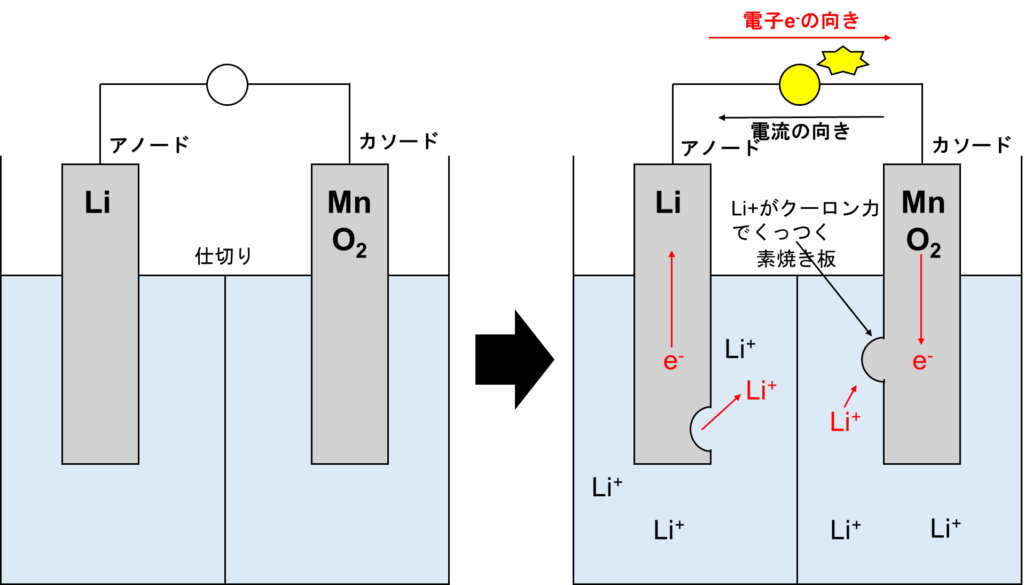
アノード側はリチウムが酸化されてリチウムイオンに、カソード側は4価のマンガンが3価に還元され(+4→+3)、クーロン力でリチウムイオンとイオン結合します。式で示すと以下の通りです。
アノード:Li→Li++e–
カソード:2Mn(Ⅳ)O2+Li++e–→LiMn2(Ⅲ)O4
ここまでは良いんですよ。問題は充電です💦 充電は以下の図示の通りです。
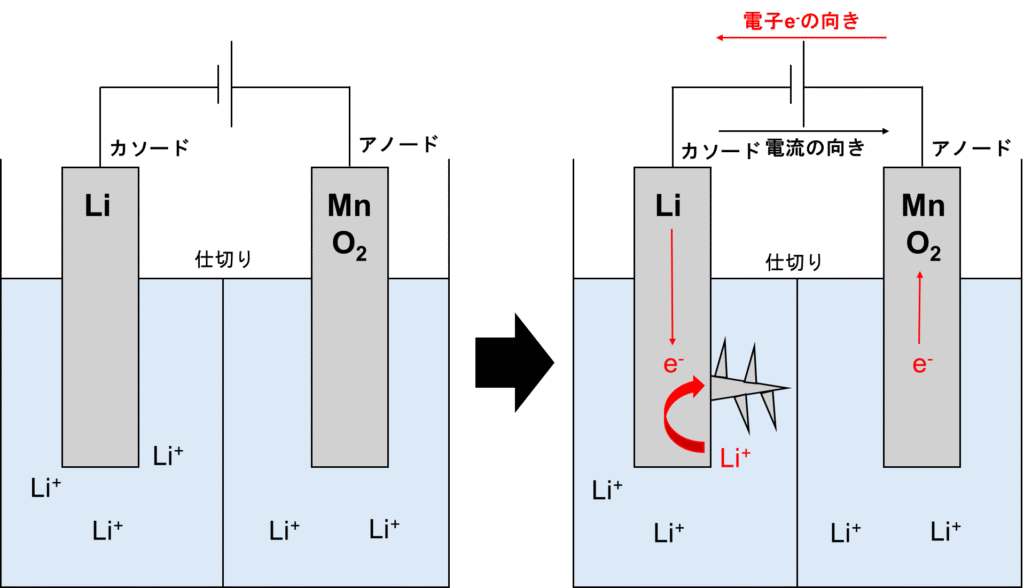
アノード側は放電の時と逆で3価のマンガンが4価のマンガンに酸化されます。カソード側も同様に放電の時と逆でリチウムイオンが還元されてリチウムが生成されますが、ここに問題が生じます。リチウムが樹状に伸びていき、電極が凸凹になってしまいます。充放電が繰り返されると、樹状の突起が仕切りを突き破りアノードと接触します。
その結果、電極間の間でたくさん電流が流れてしまい、ショートします。リチウムはパワーを持っていますので爆発の可能性があり、かなり危険です。
そのため、リチウム電池は二次電池として使用不可です。そこで本題の「リチウムイオン電池」が登場します。
リチウムイオン電池とは?
リチウムイオン電池とはその名通り、リチウムイオンがリチウムイオンそのままの形で還元されずに充放電する二次電池です。言葉だけではわかりにくいため、放電を図示すると以下の通りです。
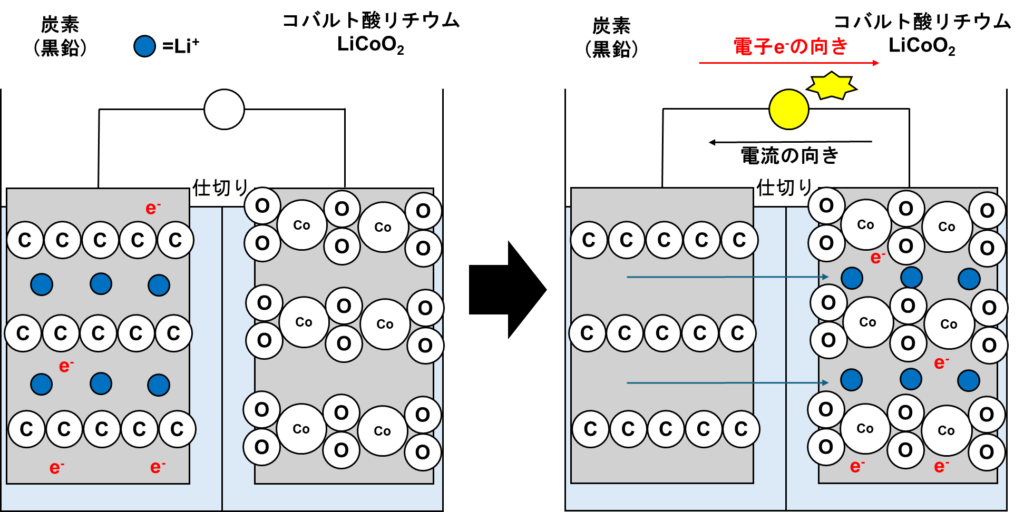
リチウムイオン電池は電極として炭素(黒鉛)、コバルト酸リチウムを使用します。どちらの電極も層になっており、その中にリチウムイオン、及び電子が存在します。存在するだけでありリチウムイオンと電子がくっつくことはありません(つまり、Li++e–→Liという反応は起こりません)。
電子は導線を通り、コバルト酸リチウムの方に移動します。しかし、それだけでは炭素電極は+に、コバルト酸リチウム側にはーに電荷が偏ってしまいます。そのため、電荷を中和するために、リチウムイオンは仕切りを通過し、コバルト酸リチウム電極側に移動します。もちろんこちらの電極も層になっており、リチウムイオンが還元されることはありません。
充電も以下の図示の通りです。
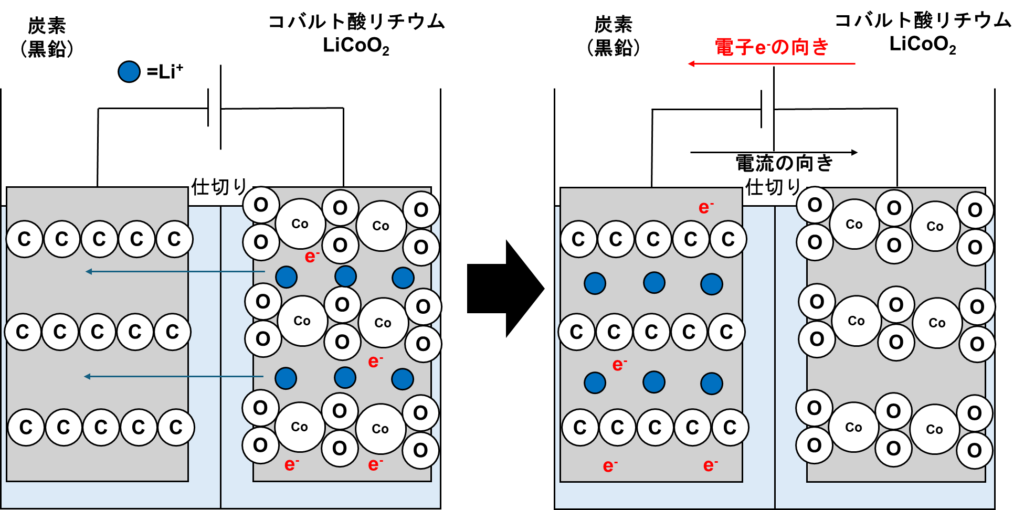
もう説明する必要がありませんね笑 電子、及びリチウムイオンは炭素電極側に移動し元通りになるわけです。完全に放電と真逆ですね。
そして、何度も説明していますが、リチウムイオンはリチウムに還元されないため、樹状の突起物が発生しません。よって、ショートも起こりません。
これがリチウムイオン電池の原理です。ちなみに、コバルト酸リチウムが電極として使用できることはグッドイナフさんが1980年に論文として報告しています。それを吉野さんがリチウムイオン電池の電極として採用したそうです。
もちろん、リチウムイオン電池は現在進行形で研究が進められています。パソコンやスマートフォン、あるいはドローン等、昔に比べて電力が必要となる製品が増えてきましたが、昔のパソコンやガラケーに比べると明らかにバッテリー寿命が延びていますよね。これも吉野さんを含めた旭化成株式会社の方々、または関係者の方々の努力の賜物ですね。
しかし、リチウムイオン電池もパワーがあるため、火災事故もたびたび起こっています。よく夏にニュースになりますが、最近でも時々ニュースにもなっていますよね(2025年12月7日現在)。
しかもリチウムイオン電池は有機溶媒を使用しているため、発火すると余計に危険です。
埃まみれにしない、直射日光に当てないなど、取扱には十分に注意する必要があります。
破棄する時も各自治体やリサイクルボックスに回収し、安全面だけではなく環境に優しい取り組みも必要です。リチウムイオン、コバルト酸リチウム等、貴重な資源の回収、再利用にもなります。
参考文献:「トコトンやさしい電気化学の本」石原顕光 著
参考文献「ノーベル化学賞に輝いた研究のすごいところをわかりやすく説明してみた」山口 悟 著
本日のブログは以上です! 最後まで読んで頂きありがとうございました!!



コメント