明けましておめでとうございます。ミドリケムです。
ちなみに、「新年明けましておめでとうございます」は間違った表現らしいですよ。「新年」と「明けまして」で2回年を越したことになるから「新年おめでとうございます」、もしくは「明けましておめでとうございます。」が正解らしいです笑
それよりも本題笑 本日はsp3、sp2、sp混成軌道の解説を行っていきたいと思います。
大学の有機化学で一番最初に習う事ですね。初めてでてくる「軌道」という言葉に戸惑った人はいませんか?僕も大学一年生の時はそうでした。本日はこの混成軌道がよくわからない、何だったっけ?、そもそも混成軌道って何?という方々に向けて解説していこうかと思います。
軌道とは
まずは軌道ですね。電子はK殻、L殻、M殻…とそれぞれの殻に収容されています。その核の中でも電子がどの位置に存在しどのような運動をしているのか測定したいのですが、電子の位置と運動量は同時に正確に測定することはできません。どちらかが正確になると、どちらかが不正確になります(ハイゼンベルクの不確定性原理)。
そのため、電子の運動を遅いシャッターカメラで撮影した様な図で表すことが多いです。すると、雲の様な図になり、その見た目から電子雲と呼ばれる事が多いです。このように、電子の存在する確率が大きい箇所程、色が濃くなるように描いたものを軌道(orbital)と呼びます。軌道とは電子の存在確率、確率分布となります。
軌道の中でも、原子核を中心に球状のs軌道、ダンベル状のp軌道、クローバー状のd軌道(クローバー状以外の形もしています)があります。他にもf軌道等もありますが、有機化学の世界ではs、p軌道を用いるため、今回はこの2つの軌道を中心に解説していきます。
以下に軌道を示していますが、ぼやけた軌道図をしています。これはそこの電子が存在している確率、いわば確率分布であり、色が濃い場所は電子の存在確率が高く、逆に薄い場所は存在確率が低いです。

1つの軌道に電子は2つ収容され、それぞれスピンの向きが違います。つまり、K殻(電子2つ収容)は1つのs軌道、L殻(電子8つ収容)は1つのs軌道、3つのp軌道が存在します。
水素の原子軌道とは?
水素はK殻に1つの原子しか存在しません。その電子はs軌道を示しており、K殻を数字の1と表します。つまり、水素は[H](1s)1と表記します。原子軌道は以下の図の通りです。
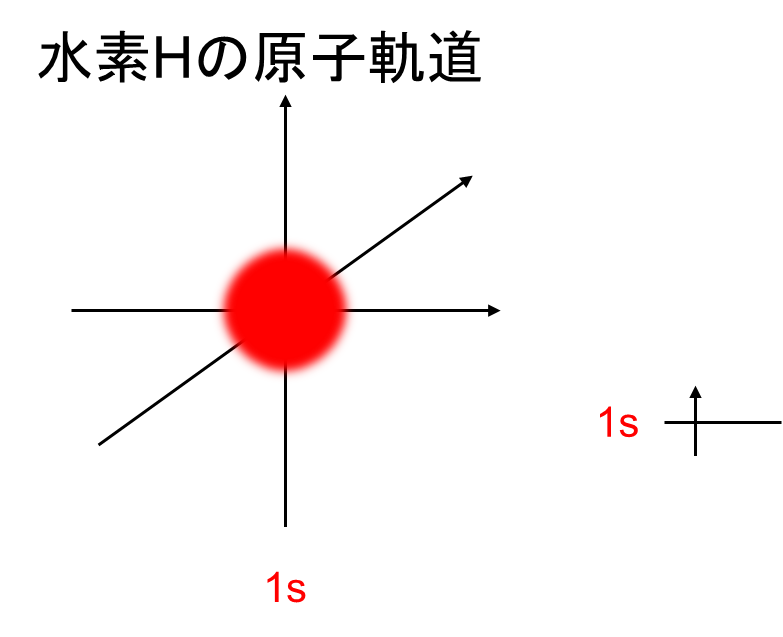
おさらいですが、電子は地球の様に自転しています。これをスピンと呼び、上右図の様に矢印で表記します。
炭素の原子軌道とは?
炭素はK殻に2つの電子、L殻に4つの電子があります。つまり、炭素は[C](1s)2(2s)2(2p)2と表記します。p軌道は3つ存在しますが、それぞれ、x,y,z軸の様に直交して存在します。原子軌道は以下の通りです。
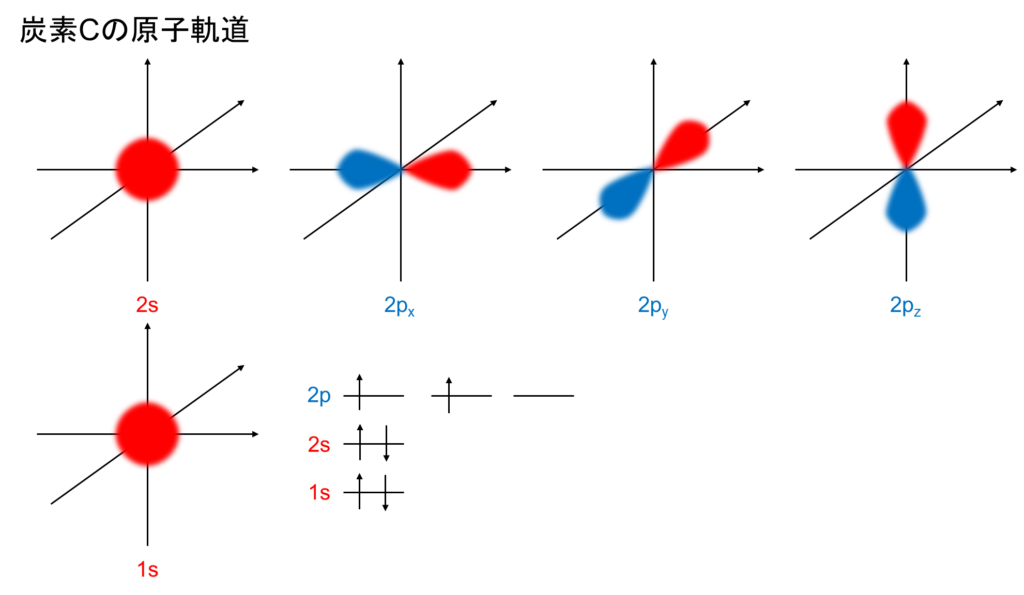
炭素は1つの1s軌道、1つの2s軌道、3つの2p軌道(互いに直交している、わかりやすくx,y,zと表記)があります。結合に利用される電子は基本的には最外殻電子、ここではL殻(2s,2p軌道)です。しかし、2s軌道は電子が2つ入っており安定しています。つまり、炭素は2つの不対電子が他の原子の不対電子と共有結合し、一つの空軌道に他の原子から非共有電子対を貰って結合、つまり配位結合をし(ry
えっ、炭素原子は4本の共有結合をするんじゃなかったのかだって?
その通りです。炭素は4本の共有結合をします。配位結合は基本的にはしません(正確には配位結合も共有結合の1種ですが…)。
じゃあ上図の原子軌道は間違いじゃないかって? そこで登場するのが混成軌道です。
その前に、軌道の色を赤と青に分けましたが、これは波動関数を解いたことにより、導き出された山と谷の様なものです。よく色にわけたり±と符合として表記されることが多いです(ここでの符合は電荷の±とは関係ありません)。
よくわからないかもしれませんが、要は電子も波であり山と谷の様なものだと思っておいてください。これ以上説明すると話が脱線してしまいますので今回は割愛します。
詳しくは下記の書籍を参考にして下さい。
混成軌道とは?
sp3混成軌道とは?
sp3混成軌道とは1つのs軌道と3つのp軌道が混ぜ合わさってできた新たな4つの混成軌道です。文章で説明するより図で説明した方が早いですね。以下の図の通りです。
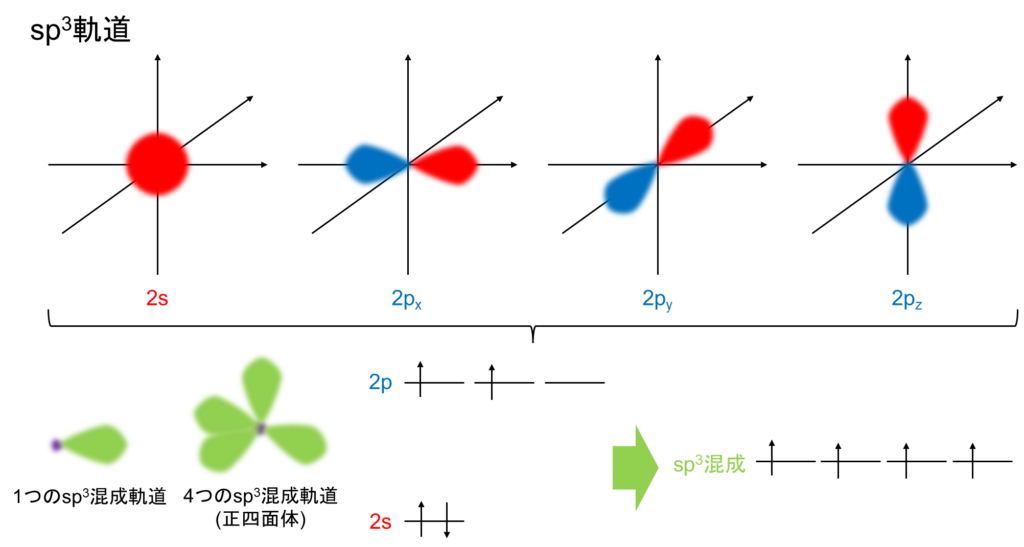
1つのsp3混成軌道は言葉では上手く表現しにくいのですが、p軌道の一つのダンベルが大きくなり、もう片方のダンベルが小さくなったような図です。それら4つの軌道が組み合わさると、正四面体のような構造になります。
そして、エネルギー順位もs軌道とp軌道の間です。これら4つの軌道に一つずつ電子が収容されていきます。
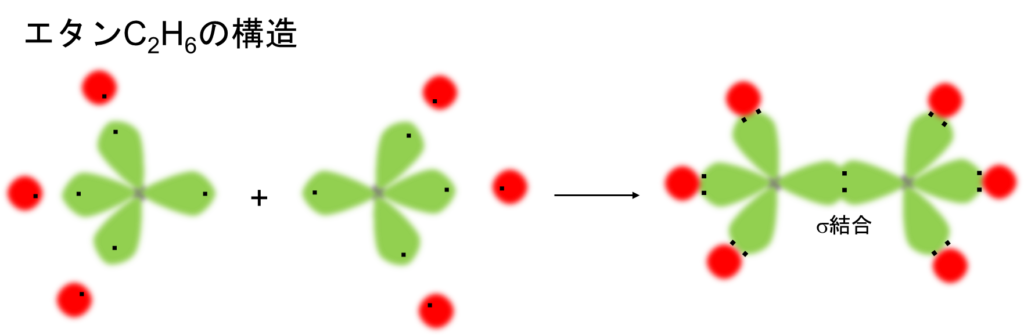
ここで、それぞれの混成軌道内の不対電子と4つの水素原子の電子同士が互いに合わさってメタンCH4ができます。この様に軌道同士が重なり合ってできた共有結合をσ(シグマ)結合と呼び、またこの時の電子をσ電子と呼びます。このため、メタンは正四面体構造をもつわけですね。4つのC-H結合力は全て同じです。言い換えると、全て等価です。
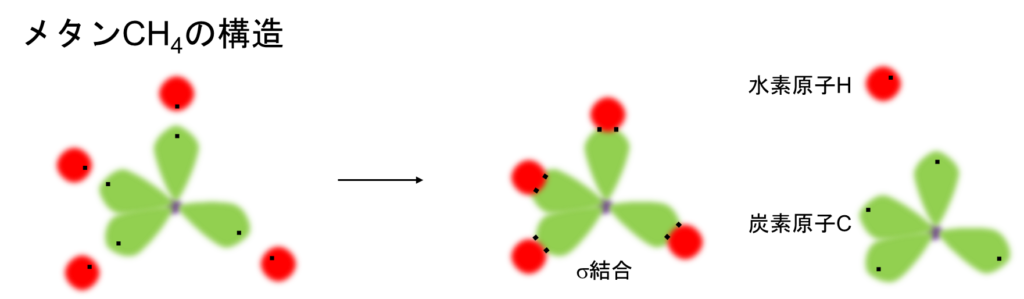
ちなみに、エタンC2H6はそれぞれ2つの炭素Cに6つの水素Hがくっつき、余ったsp3混成軌道同士でσ結合を形成します。
sp2混成軌道とは?
sp2混成軌道とは1つのs軌道と2つのp軌道が混ぜ合わさってできた新たな3つの混成軌道です。1つのp軌道が余ります。これも図で表すと以下の通りです。

エネルギー順位としては3つのsp2混成軌道に加え、1つのp軌道が上部に残り、電子もそれぞれ1つずつ割り振られています。構造としては混成軌道同士は平面構造、それの中心に直交してp軌道が存在します。
ここで、エチレンH2C=CH2の構造を紹介します。混成軌道には水素原子、ないし混成軌道同士がσ結合をします。ここまではエタンと同様です。しかし、直接ではなく側面に合わさったp軌道の電子同士が重なり合い結合を形成します。これをπ(パイ)結合と呼び、またこの時の電子をπ電子と呼びます。円周率のπとごっちゃにならないように笑

水素原子は省略していますが、炭素、水素原子は全て同一平面状に存在します。ちなみに、エチレンとして結合すると、HーCーH結合は117.4°、HーC=C結合は121.3°になります。
ここで重要なのはC=Cの結合力としてはσ結合>π結合です。つまり、反応で結合が切断されるのはπ結合です。
また、π電子はσ電子よりも動きやすいのも特徴です。これが、今後の有機化学にも大いに影響していきます。
sp混成軌道とは?
最後にsp混成軌道です。もう勘の良い人はおわかりかもしれませんが、sp混成軌道とは1つのs軌道と1つのp軌道が混ぜ合わさってできた新たな2つの混成軌道です。2つのp軌道が余ります。これも図で表すと以下の通りです。
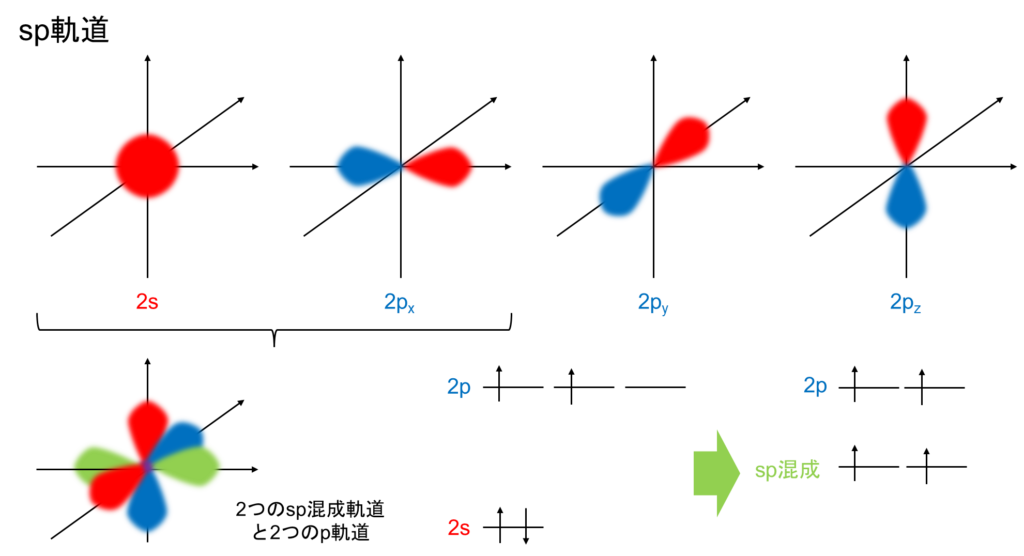
エネルギー順位としては2つのsp混成軌道に加え、2つのp軌道が上部に残り、電子もそれぞれ1つずつ割り振られています。構造も1つの混成軌道に2つのp軌道が直交して存在します。
ここでアセチレンHC≡CHの構造を紹介します。もうお分かりだと思いますが、C≡C結合は混成軌道同士で1つのσ結合、p軌道同士で2つのπ結合が形成されます。

図がわかりにくいかもしれませんが、炭素、水素原子は全て同一直線状に存在します(水素は省略していますが…)。
原子価結合法、分子軌道法とは?
最後に原子価結合法、分子軌道法という二つの結合を説明する手法をご紹介します。
というか、上記で解説してきた混成軌道等の手法が原子価結合法です。
一方、分子軌道法とは原子が結合したことにより、原子軌道から新たにできた分子のエネルギー順位で考えていく手法です。
水素分子H2で簡単に解説すると、同じ位相の1s軌道同士で結合し元の原子軌道よりエネルギー順位が低い軌道を結合性軌道、逆に違う位相の1s同士が反発し合い元の原子軌道よりエネルギー順位が高い軌道を反結合性軌道と言います。
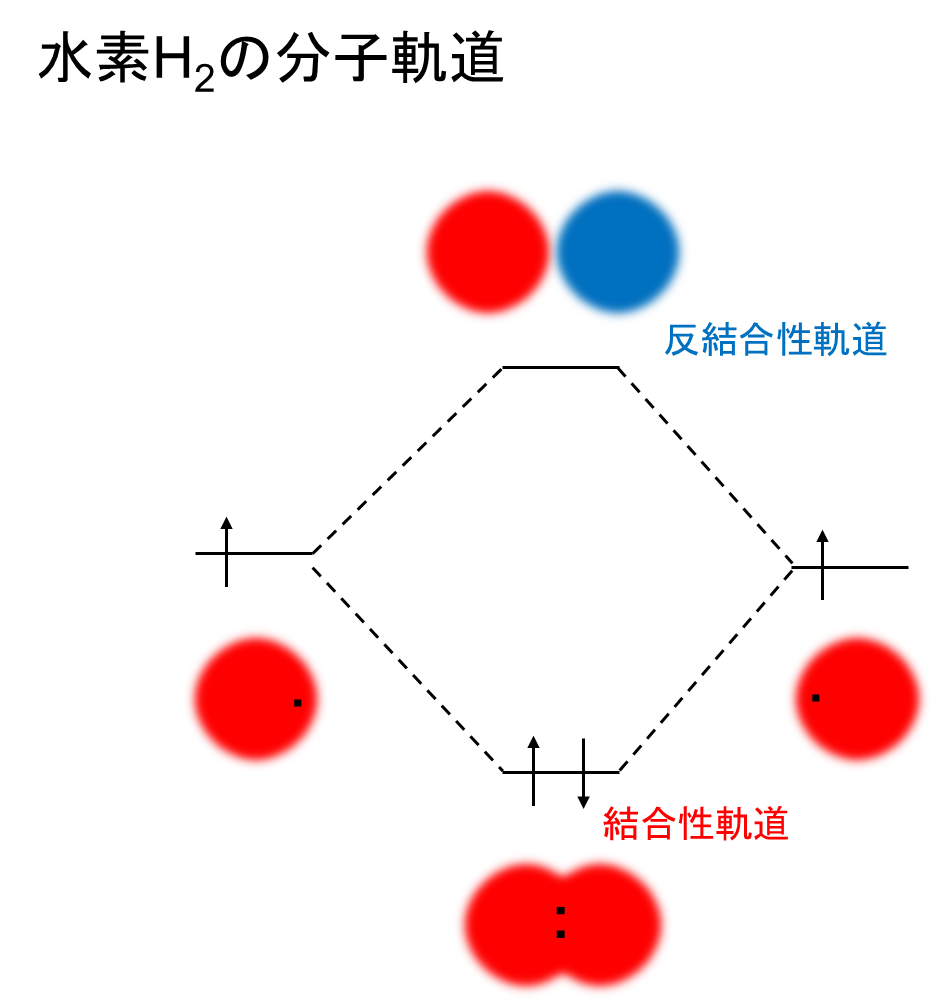
新たに出来た分子軌道を下から順に電子を収容していき、電子が詰まった最高準位を最高被占軌道(HOMO)、電子が詰まっていない最低準位を最低空軌道(LUMO)と呼びます。
分子軌道法については以下のブログでも解説しています↓↓

終わりに
以上で混成軌道の解説は終わりですが、少し難しかったですか?しかし、これを理解しておかないと今後の有機化学においてつまずいてしまうでしょう。逆に言うと、これさえ理解しておけば今後の有機化学において理解が深まると思います。
ちなみに、有機化学では原子価結合法、無機、物理化学では分子軌道法がメインとなります。個人的な意見ですが…
もちろん、有機化学で分子軌道法、無機、物理化学でも原子価結合法は必要な時もありますよ💦
参考文献「マクマリー有機化学(上)」J. McMurry 著
有機化学がメインに書かれています。
参考文献「「量子化学」のことが一冊でまるごとわかる」齋藤勝裕 著
量子化学メインで記載されています。
本日のブログはここまで!! 最後まで読んで頂きありがとうございました!!

コメント