こんにちは⭐ ミドリケムです。
今回は前回の続き、酸化還元反応に関わる電解反応について解説します。
電解反応とは電気を流すことにより化学反応を起こす、つまり電気エネルギーから化学エネルギーに変換するということです。前回の化学電池とは逆の反応です。
水の電気分解も電解反応の一部です。逆に燃料電池は化学電池の一部です。
それでは水の電気分解について解説していきます。水の電気分解は実際は水酸化ナトリウムNaOH、水酸化カリウムKOHといった塩基やH2SO4といった酸を電解質として加えて反応を起こしています。
ここで登場した電解質とは水中等、溶媒に溶かすことにより電離し、溶媒中に電気を通しやすくする物質です。いや、電気を通しやすくするというより電子の受け渡しの手助けをするという説明の方が正しいかな?
水の電気分解(塩基)
水の電気分解は図示すると以下の通りです。今回の電解質は水酸化ナトリウムNaOHとします。
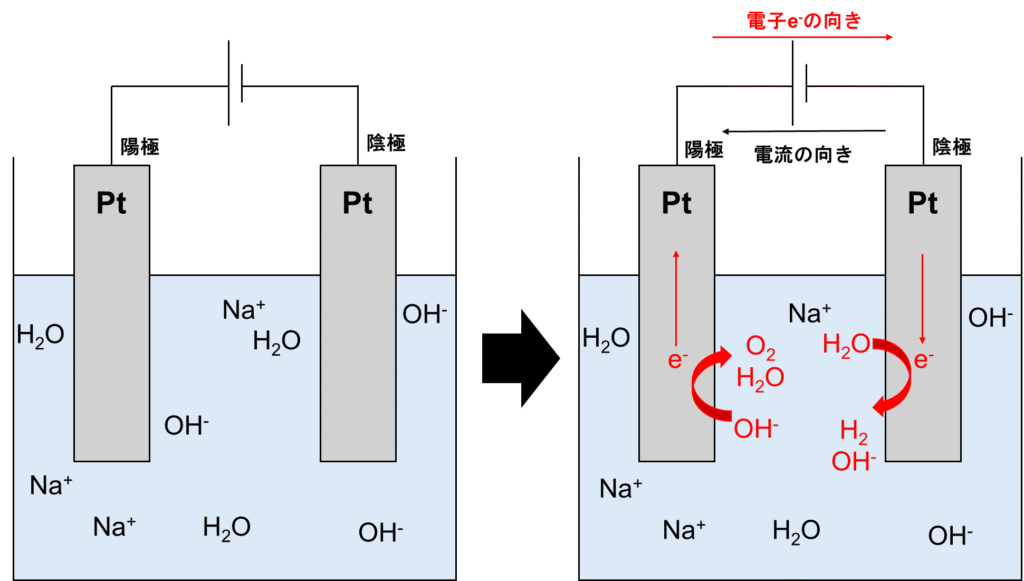
主に登場するのがナトリウムイオンNa+、水H2O、水酸化物イオンOH–です。おさらいですが、水は高速でH2O⇆H++OH–と電離しているため、水酸化ナトリウムから電離した水酸化物イオンOH–とは入れ替わっています。イオン化傾向はNa>Hです。
まず、注目すべきは電流の向きです。そして、前回のブログでも解説しましたが、電流の向きと電子の向きは逆です。つまり、電子はまず陰極に行き還元反応を起こします。ちなみに、化学電池の時は電極を「正極」「負極」と呼びましたが、電解反応では「陽極」「陰極」と呼びます。
陰極付近にある電子を受け取ってくれる物質は何でしょう?OH–はもう電子が多い状態なので受け取れません。つまり、Na+かH2Oとなります。しかし、イオン化傾向からNa+はこの陽イオンの状態で維持したい訳です。つまり、H2Oが還元されてH2とOH–に変化します。
逆に陽極では酸化反応が行われます。電子が多く持った物質といえばOH–しかありませんよね。つまり、OH–は酸化されてO2とH2Oに変化します。
まとめると、以下の反応が起こります。
陽極:4OH–→O2+2H2O+4e–
陰極:2H2O+2e–→H2+2OH–
全体:2H2O→2H2+O2
となります。水が電気分解され、水素と酸素が発生しました。これが塩基による水の電気分解です。
水の電気分解(酸)
水の電気分解は図示すると以下の通りです。今回の電解質は硫酸H2SO4とします。

今回登場するのが水素イオンH+、水H2O、硫酸イオンSO4–です。当然、硫酸から電離した水素イオンH+と水H2Oとの水素は入れ替わっています。今回登場する硫酸イオンSO4–は水中でかなり安定しているため、無視します。以前解説した通り、イオン化傾向に登場しない物質は基本的に無視でOKです。
陰極付近にある電子を受け取ってくれる物質は何でしょう?今回はH+しかありません。つまり、H+が還元されてH2が発生します。
陽極付近にある電子を提供してくれる物質は何でしょう?これまたH2Oしかありません。つまり、H2Oが酸化されてO2とH+になります。
まとめると、以下の反応が起こります。
陽極:2H2O→O2+4H++4e–
陰極:2H++2e–→H2
全体:2H2O→2H2+O2
となります。水が電気分解され、水素と酸素が発生しました。これが酸による水の電気分解です。結局の所、陽極に水素、陰極に酸素が発生します。
ちなみに、電解質を塩化水素HCl、つまり電解溶液を塩酸にした場合、陰極は塩素Cl2が発生します(2Cl–→Cl2+2e–)。イオン化傾向に登場しない物質は基本的に無視とか言いましたが、例外もあります💦ハロゲン化物イオンは電気分解では還元されてハロゲンになります。例えば次項を例にとります。
塩化ナトリウム水溶液の電気分解
結論から言うと、塩化ナトリウム水溶液(海水etc.)は電気分解され、塩素Cl2と水酸化ナトリウムNaOHが発生します。図示すると、以下の通りです。
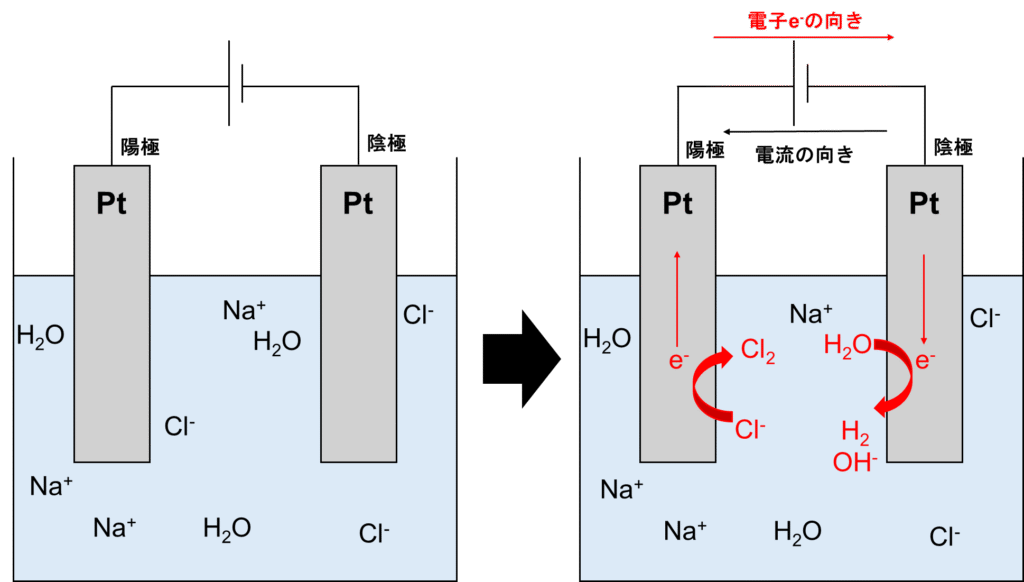
陰極では塩基での水の電気分解同様、H2Oが還元されてH2とOH–が生成されます。そして陽極ではCl–が酸化されてCl2が発生します。
まとめると、以下の反応が起こります。
陽極:2Cl–→Cl2+2e–
陰極:2H2O+2e–→H2+2OH–
全体:2H2O+2Cl–→2H2+Cl2+2OH–(Na+も加えると2H2O+2NaCl→2H2+Cl2+2NaOH)
よって、化学工業で必要な水素H2、塩素Cl2、水酸化ナトリウムNaOHが手に入ります。一石三鳥ですね♪ もちろん、水素H2は可燃性ガス、塩素Cl2は有毒性ガス、水酸化ナトリウムNaOHは強塩基等、取扱は要注意ですが…
他にも電解反応によりボーキサイトAl2O3から純粋なアルミニウムAlを取り出したり、ダイオキシン等の無害化など、様々な場面で使用されています。挙げたらきりがありません。
ちなみに、電解反応は酸化剤、還元剤を用いないクリーンな酸化還元反応とも言えます。酸化剤、還元剤は取扱要注意ですし、コスト、エネルギーが必要となり環境にも負担がかかります。逆に電解反応はそれらの心配はありません。そのため、電解反応は今も研究がされています。かくいう私も大学院時代は電解反応に関する研究を行ってきました。
アノード、カソードとは?
化学電池では「正極」と「陰極」、電解反応では「陽極」と「陰極」とで呼び方が違っていましたね。そこで新たな呼び方として「アノード」、「カソード」があります。
アノード(Anode)…酸化反応が起こる電極
(化学電池では負極、電解反応では陽極)
カソード(Cathode)…還元反応が起こる電極
(化学電池では正極、電解反応では陰極)
ややこしいですね💦 実は僕自身もよくごっちゃになります笑
ここまで、酸化還元反応として化学電池(放電)、電解反応(充電、電気分解)を解説してきました。これでもまだほんの一例です。僕もこのブログを書いている時に鉛蓄電池やNAS電池など様々な二次電池を紹介しようと思いましたが、きりがありません。
次回で最後になりますが、皆さんも一度は聞いたことがある「リチウムイオン電池」について解説していきます。
参考文献:「トコトンやさしい電気化学の本」石原顕光 著
今回はここまで!! 最後まで読んで頂きありがとうございました!!


コメント