こんにちは⭐ ミドリケムです。
今まで混成軌道や共鳴といった。有機化学の基礎を解説しました。とはいえ、やはり有機化学といえば反応です。ここで、ようやく反応について解説しようかと思います。
前回のブログは以下のリンクから↓↓


ここで、反応について多くの人がつまずくであろうSN1、SN2反応です。これの見分け方ってわかりますか?化学は眼では視えない現象を取り扱っているため中々難しいですよね。
そこで今回はSN1、SN2反応について解説していこうかと思います。
SN1、SN2反応とは
SN1、SN2反応はどちらも求核試薬が求電子試薬に求核攻撃し、二つの試薬が合体する反応、いわゆる求核置換反応です。です。反応式は以下の通りです。今回は求核試薬をNu:–、求電子試薬をXという電気陰性度が高い置換基と結合した試薬を例に説明します。
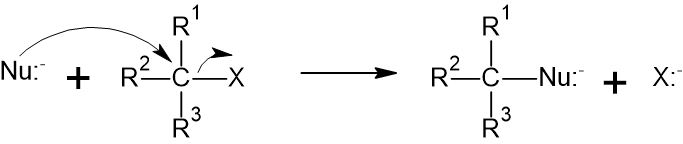
この様に求核試薬と求電子試薬が合体し、X:–が脱離基として脱離します。要は置換基が入れ替わる反応ですね。しかし、この構造式だけではSN1、SN2反応の違いはわかりませんよね。なぜなら立体的に説明していないからです。どういうことなのか、詳しく解説していきます。
SN2反応とは?
SN2反応とは求核試薬が脱離基の反対側から求核攻撃をした際、求電子試薬に求核試薬と脱離基の二つが部分的にくっついた遷移状態が存在する中間体の無い1段階で起こる反応です。アルカリと(S)-2-ブロモブタンを例に反応機構を以下に示します。

この様に水酸化物イオンが結合してブロモイオンが脱離し、(R)-2-ブタノールが完成します。ここで重要なのが、CH3、H、C2H5が立体反転していることです。求核試薬が脱離基の反対側から求核攻撃をするため、その影響で立体反転します。まるで強風により傘が反転している様です。
これがSN2反応です。反応速度もv=k[C4H9Br][OH–](kは速度定数)と求核試薬、求電子試薬の濃度共に影響してきます。
また、S,R体といった立体異性体に関しては以下のブログで詳しく解説しています。↓↓

SN1反応とは?
一方、SN1反応とは脱離基が先に脱離してカルボカチオン中間体が生成し、求核試薬がどちら側からも求核攻撃ができるという2段階の反応です。これも(R)-6-クロロ-2,6-ジメチルオクタンとと水との反応機構を例に解説します。
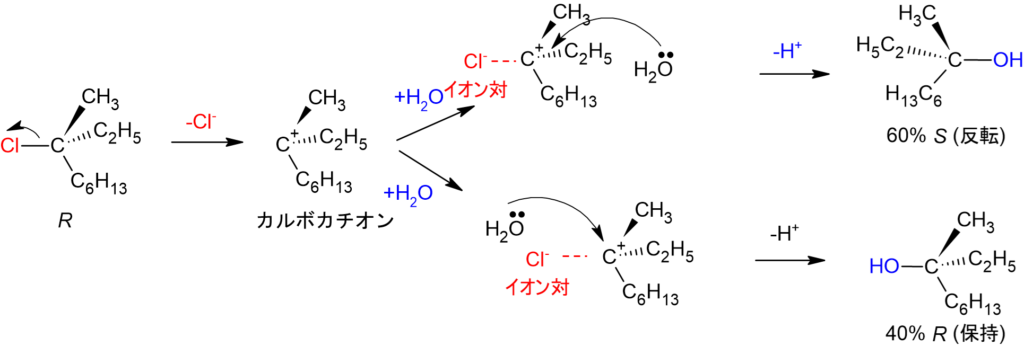
SN2反応との違いは両側から求核攻撃をすることができ、立体反転したS体と保持したR体が存在していることです。しかし、実際はS:R=60:40と反転していることが多く、50:50(ラセミ体)ではありません。これは脱離基Cl–が結合は切れたものの、イオン対としてカルボカチオン側に存在しているため、求核攻撃の邪魔をしてR体が生成しにくくなったためです。
これがSN1反応です。反応速度はv=k[C10H21Cl](kは速度定数)と求電子試薬の濃度のみ影響してきます。つまり、脱離基の脱離がSN1反応の律速段階(全体の反応速度を決定づける最も遅い反応)ということです。
SN1、SN2反応の見分け方
ここで、皆さんがよくつまづくSN1、SN2反応の見分け方について解説していきますが、解説する前にこんなことを言うのもよくないかもしれませんが、SN1、SN2反応を完璧に見分けることは難しいのです。反応にもよるのですが、SN1、SN2反応両方起きたりもしますので💦
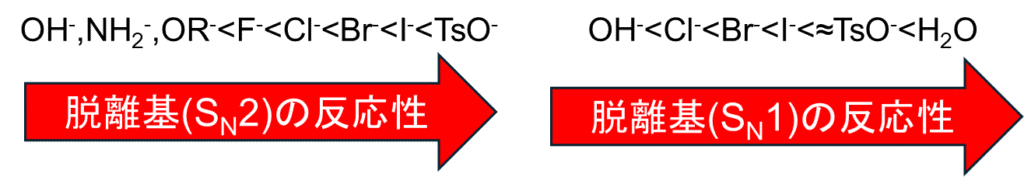
しかし、見分け方はあります。重要なのは基質(求電子試薬)、脱離基、求核試薬、および溶媒です。順を追って解説していきます。
基質
SN2反応はいかに基質に求核試薬が攻撃しやすいかがポイントとなります。つまり、求核攻撃される際に立体障害が小さく求核試薬が基質に近づきやすさが決め手となります。臭素と結合した炭素を例にとると以下の通りです。
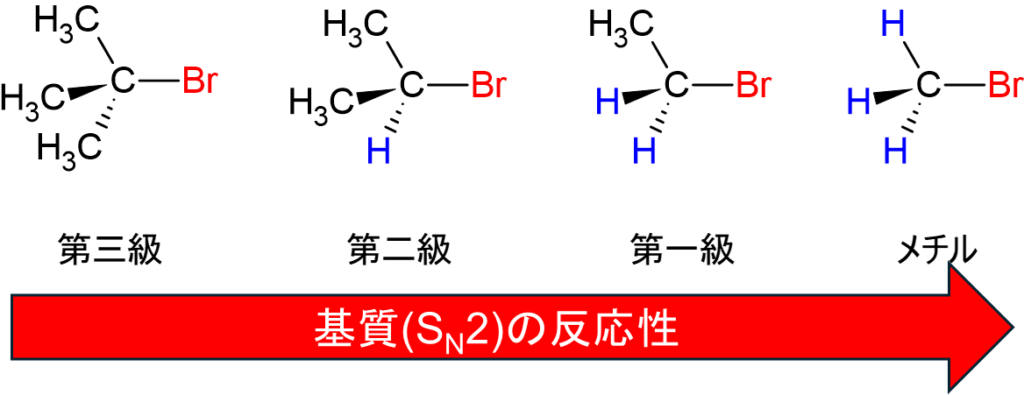
水素とメチル基では当然メチル基の方が立体障害は大きいですよね。つまり、メチル基が少なく水素が多い程、SN2反応は優位になります。
一方、SN1反応はいかにカルボカチオンが安定状態になりやすいかがポイントとなります。カルボカチオンが安定する程、脱離基は脱離しやすくなります。カルボカチオンは電子が少ないため電子を欲しがります。つまり、電気陰性度で電子を与える誘起効果、もしくはπ電子が非局在化し電子の隔たりが小さくなる共鳴効果が強い基質がSN1反応に優位となります。例をとると、以下の通りです。

ちなみに基本的には誘起効果より共鳴効果の方が安定します。とはいえ、あまりにも共鳴効果が強過ぎると安定化し過ぎるため逆に反応しにくくなります。そのため、共鳴効果もほどほどが良いという訳ですね。
まとめとして、SN2反応は立体障害が小さい程、SN1反応はカルボカチオンが安定化する程(安定化し過ぎは×)起こりやすいというわけです。
脱離基
脱離基ははじめから言うと、SN1、SN2反応どちらも同じです。要は脱離した後のアニオンが安定であることが大事です。
あえて違いを言うと、SN1反応では水が脱離しやすいということですかね。厳密にいうと、ヒドロキシ基にプロトンがくっついた後、水分子として脱離します。
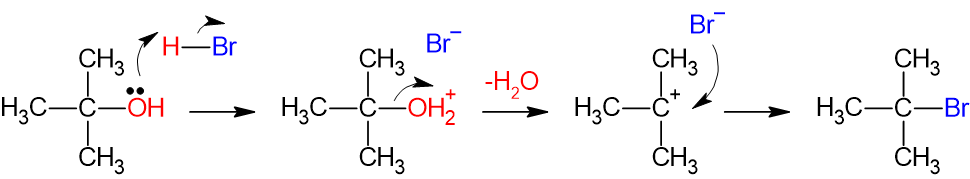
ちなみに、ヒドロキシ基としては脱離はほぼ不可です。というのもヒドロキシ基は水溶媒以外では不安定だからです。よって、ヒドロキシ基を脱離したい場合は一度プロトン化してから水分子として脱離する必要があります。
求核試薬
SN2反応は求核試薬の求核攻撃から反応が始まります。つまり、求核性が大きいほど反応性が良好です。
一方、SN1反応では脱離基の脱離が律速段階であるため、求核試薬はあまり影響しません。
溶媒
溶媒はプロトン性溶媒かどうかが鍵となってきます。プロトン性溶媒とはーOH,-NH等含んだ電気陰性度により電子が不足したプロトン、もっと簡単に言うと塩基を加えるとプロトンが脱離しやすい溶媒です。
プロトン性溶媒は主にアニオンと水素結合を形成し、アニオンを安定化させます。溶媒をアルコール、アニオンをブロモイオンで例えると以下の通りです。
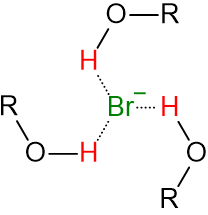
SN2反応は原料である求核試薬を安定化させてしまい、反応の妨げになってしまいます。また、極性が高い方が共存する他のカチオンと溶媒和するが、アニオンである求核試薬とは溶媒和しません。つまり、極性が高い方が反応しやすいです。主に極性非プロトン性溶媒を使用します。

一方、SN1反応は中間体であるカルボカチオンが安定化、つまり生成しやすい極性溶媒の方が反応しやすいです。プロトン性溶媒かどうかは関係ありません。エタノールと水の混合溶媒で合成すると、極性の高い水が多く含んだ方が反応を起こしやすくなります。

まとめ
SN2反応は脱離基、および求核試薬がくっついた遷移状態となり、立体反転が起こる1段階の反応です。
一方、SN1反応は脱離基が脱離後に求核試薬と反応するため、立体反転が起こった物質、起こらなかった物質両方が生成する(立体反転する方が多いですが)カルボカチオン中間体が存在する2段階の反応です。
また、基質では立体障害が小さいほどSN2反応、脱離基が脱離しカルボカチオンが安定しやすいほど(安定しすぎも×)SN1反応が起こります。
脱離基はどちらも脱離後に安定する方が反応が起こりやすいです。
求核試薬はSN2反応では求核性が大きいほど反応しやすく、SN1反応は特に影響しません。
溶媒はSN2反応では極性非プロトン性溶媒、SN1反応は極性溶媒が良好です。
いかがだったでしょうか? だいぶややこしいかもしれませんが、要は遷移状態、カルボカチオン中間体の違いが重要です。そして、それぞれの反応の特徴を理解していれば見分け方は丸暗記する必要もありません。何事も原理を理解しておくことが重要です。
参考文献「マクマリー有機化学(上)」J. McMurry 著
今回のブログはここまで!! 最後まで読んで頂きありがとうございました!!

コメント