こんにちは⭐ ミドリケムです。
本日は有機化学の基本、共鳴について解説していきます。
まずは前回のブログのおさらいから。
有機化合物は主にσ結合とπ結合から成っており、前者の方が結合力が強いです。σ結合は主に軌道同士の直接交わって結合し、π結合は側面に合わさった軌道(主にp軌道)のπ電子が重なり合い結合します。
前回のブログは以下のリンクから↓↓

ここで本題の共鳴です。結論からいうと、共鳴とはπ電子が軌道間を飛び回って軌道が広がり、安定度が増す現象です。
言葉で説明するよりも、実際の共鳴構造を見ていきましょう。
ベンゼンの共鳴構造
よく例で用いられるのはベンゼンです。ベンゼンは6つのsp2混成軌道を持った炭素C同士で結合された結合であり、混成軌道は炭素C同士、ないし水素Hとσ結合をします。残ったp軌道中の1個のπ電子同士がp軌道間を飛び回ってベンゼンは安定構造を保ちます。図示すると以下の通りです。ちなみにp軌道のみ記載し、混成軌道、水素Hは省略しています。

また、共鳴構造式では以下の通りに書きます。ちなみに共鳴構造式の矢印は「↔」を用います。ベンゼンに至っては共鳴構造式を正六角形の中に〇を描いて示すこともあります。

正しくいうとハイゼンベルクの不確定性原理より、電子を含めた粒子の位置と運動量を同時に正確に測定することは不可能なため、電子は電子雲の様な確率分布しか描けません。これが軌道でしたね。
しかし、共鳴構造式で書くときは以下の様に矢印を用いて描くことしかできないため、上記の様な共鳴構造式となるわけです。
つまり、共鳴構造式の様に電子が行き来しているわけではなく、p軌道同士が広がり、その間にπ電子が飛び回り電子密度は同等になるというイメージを持ってください。これを非局在化と呼びます。
また、共鳴をする箇所は側面に重なったp軌道同士が必要なため、平面構造であることもおさえておいて下さい。
アミド結合の共鳴構造
続いてはアミド結合(タンパク質の時はペプチド結合とも呼ぶ)についての共鳴について解説していきます。
実は窒素N、酸素Oも混成軌道を形成します。アミド結合を形成する窒素N、酸素Oはsp2混成軌道を形成します。炭素Cと比べると窒素Nは1個、酸素Oは2個電子が多いため、混成後の原子軌道は以下の通りとなります。
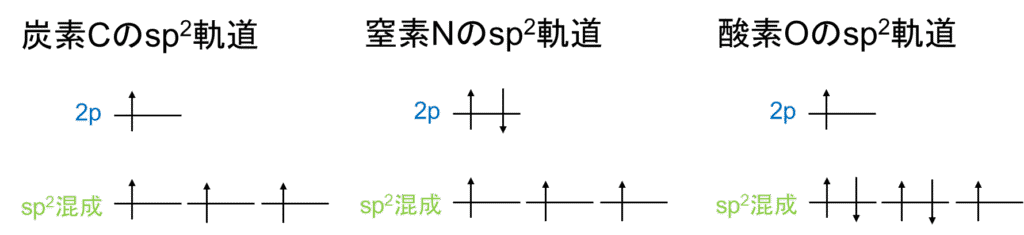
今回の電子配列は上図の通りとなりますが、結合によっては変わってきます。あくまでアミド結合時は上図の通りとなります。
窒素Nで例えると、ピリジンとピロールが例として挙げられます。詳しくは以下のブログで解説しています↓↓

窒素Nの非共有電子対は2p軌道に存在し、混成軌道の電子は他の原子とのσ結合に使用されます。一方酸素Oの2つの非共有電子対は混成軌道に存在し、残った1つの混成軌道の電子は炭素Cとのσ結合に、2p軌道の電子はπ結合に使用されます。
共鳴構造式は以下の通りです。

共鳴構造式としては上図の通りにしか描けませんが、イメージとしてはp軌道上の4つのπ電子(炭素C上に1つ、窒素N上に2つ、酸素O上に1つ)がそれぞれのp軌道上で非局在化し、軌道が広がっていると思って下さい。通常のアミド結合にはC-N結合に二重結合は描きませんが、実際は二重結合性を有しています。
この様に、共鳴することでアミド結合は強力な結合となります。基本的には強アルカリでしか結合は切断されません。この強力な結合によってタンパク質は形成されており、我々の身体や酵素が形成されているのですね。
タンパク質に関しては以下のブログで解説しています↓↓


カルボキシアニオンの共鳴構造
最後にカルボン酸からプロトンH+が脱離したカルボキシアニオンの共鳴構造を解説していきます。
カルボキシアニオンの共鳴構造式は以下の通りです。

これも、炭素C、酸素O上のp軌道間でπ電子が非局在化しているため、カルボキシアニオンは安定化します。そのため、プロトンが脱離しやすくなり、カルボン酸は酸性を示すのです。
よって、カルボキシアニオンは炭素Cに二つの酸素Oが結合していますが、その結合はどちらも等価です。
終わりに
以上が共鳴の解説となります。もちろん、これはほんの一例にしか過ぎません。世の中には様々な化合物が共鳴しています。これも有機化学(無機化学でもそうですが)では重要な現象であるためしっかりと理解しておきましょう。
参考文献「マクマリー有機化学(中)」J. McMurry 著
芳香族のことに関して詳しく記載されています。
参考文献「マクマリー有機化学(下)」J. McMurry 著
アミノ酸のことについて詳しく記載されています。
本日のブログはここまで!! 最後まで読んで頂きありがとうございました!!

コメント