こんにちは⭐ ミドリケムです。
前回は酸・塩基の事について解説しました。今回はもう一つ重要な反応をご紹介します。
それは酸化還元反応です。
覚えていますか? え?酸素がくっつくことを酸化、離れることが還元じゃないの?と思っている方もいらっしゃると思いますが、これも高校化学から定義が広がるのです。おさらいしましょう。
酸化還元反応とは?
酸化(oxidation)…電子を失う反応
還元(reduction)…電子を受け取る反応
以上です。最後まで読んでくれてありがt(ry
いやいや、こんな簡単に終わらせるなと言われますね笑 しかし、酸化還元反応は酸・塩基反応と違ってこれだけが定義なのです。酸素がくっつく、脱離する反応と思っていた方々はここでアップデートしておいてください。
また、酸化と還元は電子の受け渡し、つまり酸化と還元は同時に起こります。
例として水の生成やメタンのクロロ化を例にとりましょう。
その前におさらい。
電気陰性度…原子が電子を引き付ける力を示したもの
水素Hは2.20、炭素Cは2.55、塩素Clは3.16、酸素は3.44です。並べると、H≦C<Cl<Oです(水素Hと炭素Cはほぼ同じ)。
水の生成式:2H2+O2→2H2O
水素分子H2は水素原子同士がくっついていたので同じ電気陰性度同士、つまり電子はどちらの水素原子にも隔たりがなく持っています。酸素分子O2も同様です。それが水分子になると構造がHーOーHとなります(実際は直線ではなく折れ線状態ですが…)。水素原子Hと酸素原子Oとでは後者の方が電気陰性度が高いですよね。つまり、水素分子は電子を少し奪われているため、酸化され、酸素分子は電子を少し貰っているため還元されます。完全には電離していませんが、酸素原子が水素原子との共有電子対を引っ張っているため、これも酸化還元反応です。
メタンのクロロ化:CH4⇆CH3Cl⇆CH2Cl2⇆CHCl3⇆CCl4
名称:左からメタン、クロロメタン、ジクロロメタン、クロロホルム、四塩化炭素
電気陰性度としては炭素Cと水素Hはほぼ同じですが、炭素Cと塩素Clでは後者の方が強く、右に行くほど共有電子対は塩素Clの方へ引っ張られます。つまり、右に行けば酸化され、左に行くほど還元されます。これは酸素が用いられない酸化還元反応ですね。
酸化還元反応ではよく酸化剤、還元剤という物質を使って反応させます。これは以下の通りです。
酸化剤…酸化力が強く、相手を酸化させる(自分は還元される)。
例.二クロム酸カリウムK2Cr2O7、過マンガン酸カリウムKMnO4 etc.
還元剤…還元力が強く、相手を還元させる(自分は酸化される)。
例.水素化ホウ素ナトリウムNaBH4、水素化リチウムアルミニウムLiAlH4 etc.
よく間違えるのは酸化剤は相手を酸化し、自分は還元されます。還元剤はその逆です。例えるならAという物質を酸化したい、と思ったら酸化剤を使って酸化します。以下の式を例にとります。
A(酸化したい物質)+B(酸化剤)→C(Aが酸化された物質)+D(酸化剤Bが還元された物質)
上記の水の生成で例えると、水素H2は還元剤、酸素O2は酸化剤となります。ごっちゃになっている人もいますので間違えない様にして下さい。
イオン化傾向とは?
ここでもう一つご紹介するのはイオン化傾向です。イオン化傾向とはその名の通り、金属元素が電子を手放して陽イオンになる、つまり酸化され易さを示す傾向です。イオン化傾向とは以下の通りです。
Li>K>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>H>Cu>Hg>Ag>Pt>Au
有名な覚え方として「リッチに貸そうかな?まぁあてにすんなひどすぎる借金」です。元素を当てはめると、「リッチ(Li)に貸そう(K)か(Ca)な(Na)?ま(Mg)ぁ(Al)あ(Zn)て(Fe)に(Ni)すん(Sn)な(Pb)ひど(H)す(Hg)ぎ(Ag)る借(Pt)金(Au)」
要はリチウムLiがイオンLi+に酸化され易く、金AuはイオンAu+orAu3+に酸化され難いということです。実際、K~Naは水に触れるだけで急激に酸化され危険であるため禁水性であり(石油中に保存)、Pt、Auは酸化力が強い王水(濃塩酸:濃硝酸=3:1)にしか酸化されません。
ん?金属に関係ない水素Hも混ざっているって? 鋭い所に目を付けましたね笑 金属ではありませんが、水素Hもイオン化傾向に含まれていると次の項目で考えるのに便利だから含まれているのです。
化学電池とは?
酸化還元反応を語る上で忘れてはいけないのが化学電池ですね。化学電池とは化学反応により電子の移動が起こり電流を流す(化学エネルギーから電気エネルギーへ変換する)ものです。
ボルタ電池とは?
まずは有名なボルタ電池から説明します。ボルタ電池は正極を銅、負極を亜鉛にして導線で繋ぎ、希硫酸(硫酸水溶液、つまり、硫酸は水中で電離:H2SO4→2H++SO42-、正確にいうとH2SO4+2H2O→2H3O++SO42-ですが、ややこしいため前者の反応式で進めます)に浸して電流を起こす化学電池です。導線に豆電球を繋げ、反応させると以下の図示の通りとなります。
ボルタ電池
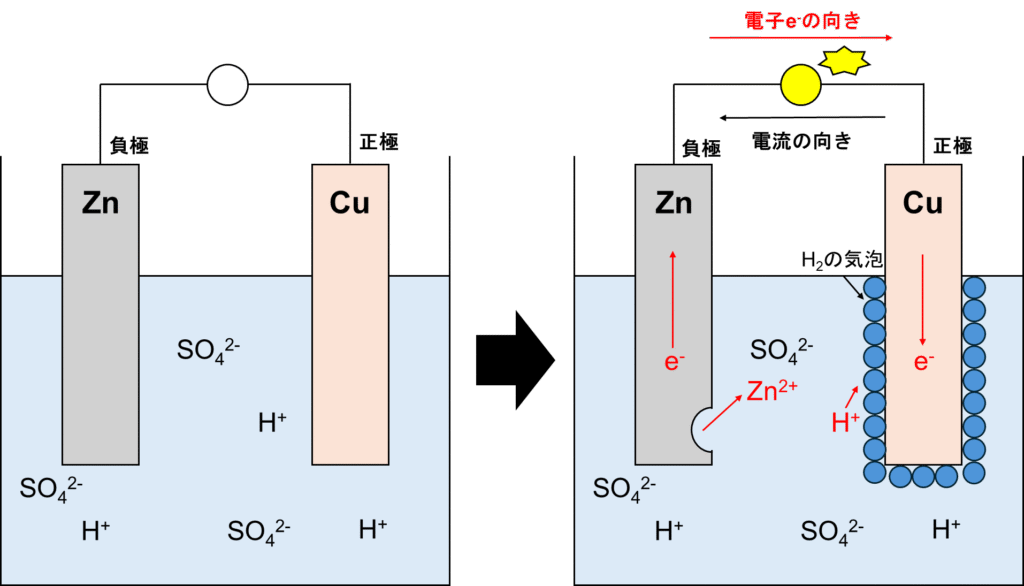
まず、ここで登場するのがZn,Cu,Hです(SO42-は水中では安定して存在しているため、反応には関与しません。基本的にはイオン化傾向に登場しない物質は無視しましょう。)。イオン化傾向としてはZn>H>Cuでしたね。Znは陽イオンになりたい、言い換えると電子e–を手放し酸化されたいということです。電子e–は導線を通って豆電球を光らせ、正極に行きます。正極の周りには電子e–を受け取る、言い換えると還元される物質は水素イオンH+しかありません(銅Cuは還元できません。銅イオンCu+ or Cu2+は還元できます。ごっちゃにならない様に!!)。つまり、水素イオンが還元され、水素が発生します。つまり、以下の反応が起こります。
正極:2H++2e–→H2
負極:Zn→Zn2++2e–
ちなみに、電流と電子の向きがなぜ逆なの?と疑問に思った方々はいませんか?これは昔、電子の事がわかっていなかった時代に電流の向きは+からーへの向きにしようと決めてしまったからです。言い換えると+から離れーに近づく、+電荷の動く方向が電流の向きです。電子は当然ー電荷です。つまり、電流の向きの定義と逆方向です。だから電流と電子の向きは逆方向になっちゃった訳ですね。
ちなみに勘のいい人はお気づきかもしれませんが、水素イオンH+と亜鉛イオンZn2+は電流の向きと同じですよ。
ちなみに、ボルタ電池は正極に水素の気泡が発生します。これが、水素イオンの還元の邪魔になり徐々に還元率が低下します。つまり、起電力が落ちてしまいます。そこで次に登場するのが次項です。
ダニエル電池とは?
ボルタ電池の欠点を解消したのがダニエル電池です。正極を銅、負極を亜鉛にして導線で繋ぐ所までは同じです。ボルタ電池と違うところは溶液を正極には硫酸銅水溶液、負極には硫酸亜鉛水溶液にし、間に素焼き板を挟んだことです。反応させると以下の図示の通りとなります。
ダニエル電池
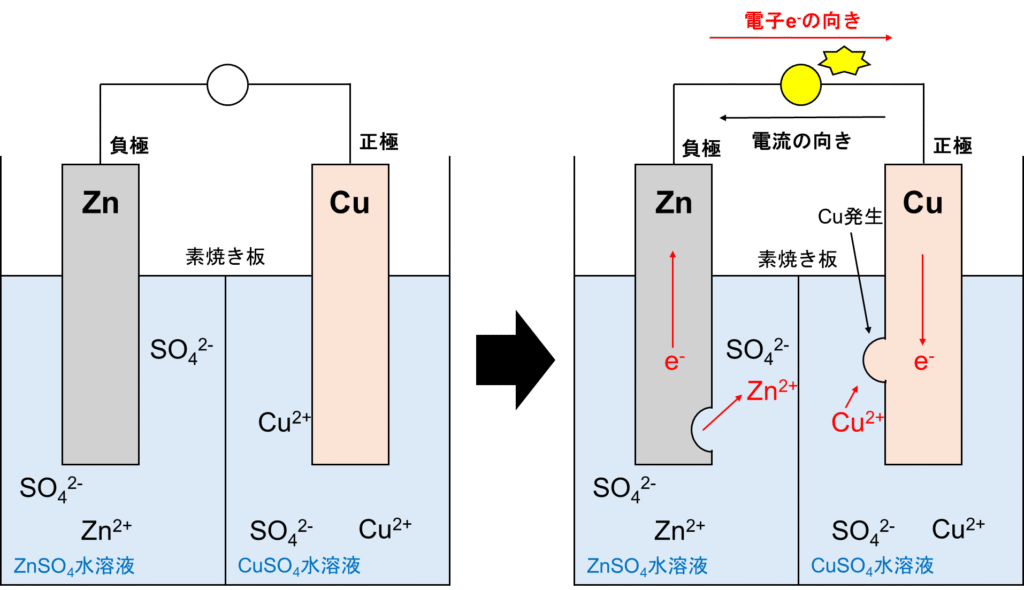
負極では亜鉛が酸化され、電子が導線を流れます。ここまではボルタ電池と同じです。違う所は正極です。ボルタ電池では水素イオンH+が存在していました。いや、正確には水も高速で電離し水素イオンH+(もっと厳密にいうとヒドロニウムイオンH3O+)が存在しています。しかし、今回は銅イオンCu2+も存在しています。イオン化傾向はH>Cuでしたね。つまり、銅イオンCu2+が還元されて銅Cuに変化しているのです。そのため、水素の気泡が発生せず、起電力が低下しません。つまり、以下の反応が起こります。
正極:Cu2++2e–→Cu
負極:Zn→Zn2++2e–
要は負極の亜鉛板は溶解し、銅イオンが析出して正極の銅板は膨らみます。しかし、このままでは正極側には硫酸イオンしか存在せず、負極側には亜鉛イオンの濃度が増大し、電荷に隔たりが生じます。
ここで素焼き板の登場です。素焼き版は2つの役割を持っています。
1つ目は硫酸亜鉛水溶液と硫酸銅水溶液を混合させないためです。混合させてしまうと、亜鉛板と銅イオンが直接反応してしまい(Zn+Cu2+→Zn2++Cu、イオン化傾向Zn>Cuのため)、電池としての機能が果たさなくなるためです。
2つ目は素焼き板の小さな穴(細孔)にイオンを移動させ電荷的に中性を保つためです。硫酸イオンを正極から負極へ、亜鉛イオンを負極から正極へ移動させることにより、溶液が電荷的に中性になります。
要は完全にイオンの移動をシャットダウンするのではなく、わずかに移動させることで、亜鉛板と銅イオンとの反応を防ぎつつ、溶液の中性を保っているというわけですね。しかし、銅イオンもわずかに負極へ移動しているため、完全に亜鉛板と銅イオンとの反応を防いでいる訳では無いのですね。
また、両方の化学電池は充電が不可能です。一度使ったらもう使用不可能です。これを一次電池といいます。一次電池も我々がよく知っている乾電池、つまりマンガン乾電池やアルカリ乾電池等、ボルタ、ダニエル電池に比べて起電力も高く長持ちする様になってきました。
しかし、やはり充電して繰り返し使いたいですよね。それができる電池を二次電池といいます。例として、自動車のバッテリー等に使われている鉛蓄電池、大型蓄電池としてNAS電池、逆にパソコンやスマートフォンに使用される小型でありながら大容量の充電が可能なリチウムイオン電池等、様々な電池が開発されています。二次電池の進化により、ソーラーパネルで過剰にできてしまった電気を保つことができます。電気って実はほっておくと熱エネルギーに変換されて無くなってしまうのです。そのため、電気エネルギーを用いて化学反応、つまり化学エネルギーとして保管するという訳です。また、リチウムイオン電池も小型ながら長持ちする素晴らしい電池であり、これを開発した第一責任者である旭化成株式会社の吉野彰さんは2020年にノーベル化学賞を受賞しました。携帯もガラケーからスマートフォンに代わり確実に電力を多く使うようになりましたが、バッテリー容量は減るどころかむしろ増えてますよね。旭化成株式会社の方々は今もリチウムイオン電池の改良に挑戦している証拠ですね。これらも機会があればブログで紹介できたらと思っています。
というか、何気に充電という言葉が登場しましたが、充電ってどういうことか説明できますか?電池に電気を貯めることじゃないの?と思った方もいらっしゃるかもですが、どさくさに紛れて私説明しましたよ笑
放電である化学電池とは化学反応により電子の移動が起こり電流を流す、つまり、化学エネルギーから電気エネルギーへ変換するものと説明しました。
充電はその逆、電気エネルギーを用いて化学エネルギーを得る、つまり電気を流して化学反応を起こす事です。これを電解反応と言います。水の電気分解も電解反応の一部です。少しブログが長くなってしまったため、電解反応については次回解説していきます。
参考文献:「トコトンやさしい電気化学の本」 石原顕光 著
本日はここまで!!最後まで読んで頂きありがとうございました!!


コメント